|
|
|
1 原子の構造か
【原子の構造】
原子は物質を構成する基本的な粒子で,金属などの原子からなる物質の最小単位である。例えば,銅原子は銅としての最小粒子で,これ以上分解すると銅ではなくなる。そこで原子を分解するとどうなるか(原子の構造)を考えてみる。
電子の発見
絶縁体(本来は電気を通さない物質)でも電極を入れ高電圧をかけると電流が流れる。この現象を〔 放電 〕という。また,クルックス管(真空放電管)中で放電させる(真空放電という)と,管内で蛍光が見られ,陰極から陽極に向かって何か出ていることが分かり,これを〔 陰極線 〕とよんだ(左下図)。陰極線は磁石や電圧によって曲げられ,電圧をかけると+側に曲がることが実験で分かった(右下図)。
|
|
|
|
これらの現象から,1800年代後半,イギリスのトムソンらは陰極線の正体を−の電気を持った非常に小さな(原子よりも小さい)粒子の流れであることを実証した。この−の電気を持った粒子を〔 電子 〕という。
原子構造の解明
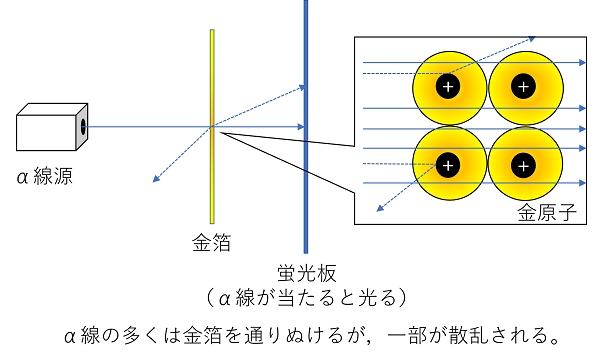
イギリスのラザフォードは1911年放射性物質のラジウムから放出されるα線(放射線一種で,+の電荷をもった粒子の流れ)を金属(原子からなる物質)にあてると,一部のα線が散乱することを観察し,これは+どうしの反発によって起こると推測し,原子には+の電気をもった,質量の大きな粒子が存在することを発見し,この粒子を〔 原子核 〕と呼んだ。
|
 |
|
また,原子そのものは電気を持たない(電気的に中性である)ことから,−の電気をもった〔 電子 〕も存在することが考えられ,これをもとに,デンマークのボーアが1913年に原子模型を考案した。さらにラザフォードは,原子核は〔 中性子 〕と〔 陽子 〕という2種類の粒子からできていることを予測し,1932年イギリスのチャドウィックによって証明された。
原子の構造
原子核(陽子と中性子からなる)を中心にし,その周りに電子が存在する。
|
 |
| 例)ヘリウムHeの原子模型 |
 |
|
★ 中性子の数は,原子によって決まっているわけではない。同じ原子(陽子数が同じ)でも,中性子数が異なるものが存在する。
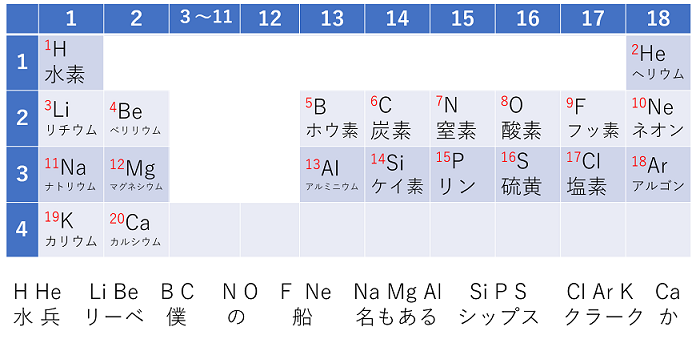
原子番号
例えば,陽子を1個持っていれば水素H,2個持っていればヘリウムHeというように,原子は陽子を何個もっているかで,その種類が決まる。原子が持っている陽子の数をその原子の〔 原子番号 〕という。また,元素の周期表は元素記号が原子番号の順に並んでいる。また,電子数=陽子数なので,原子番号が分かれば,その原子が電子を何個持っているかも分かる。原子番号1〜20までの原子は順番にいえるようにしよう。
|
 |
|
【電子配置】
原子を構成する電子は,原子核の回りの軌道を運動しているイメージである。電子は原子核の周りにいくつかの層(電子殻という)に分かれて存在し,エネルギーの低い順に原子核の近く(内側)から収容されている。外側の層ほど多くの電子が収容でき,内側から2個,8個,18個,32個,…といった具合に収容されていく。これを電子配置という。次に一部の原子の電子配置を図示する。
|
 |
|
それぞれの原子の電子配置の違いは最も外側の電子数である。周期表で最も右の縦の並び(18族)の原子(2He,10Ne,18Ar,…)は,バランスの良い安定な電子配置をしている。実際に2He,10Ne,18Ar,…は他の原子と結合せず,原子単独で存在できる。
|
 |